Результаты неинвазивной оценки оксигенации головного мозга в качестве прогностических факторов у пациентов, которым выполняется операция на дуге аорты
Цели: Хирургическое восстановление дуги аорты остается технически сложным вмешательством, которое связано с осложненным течением и высокой летальностью. Оксиметрия головного мозга представляет собой неинвазивную методику, с помощью которой можно контролировать регионарное насыщение кислородом лобной коры. Мы выдвинули гипотезу о том, что величина и продолжительность интраоперационного снижения регионарного насыщения кислородом связаны с послеоперационной дисфункцией органа. Помимо этого, мы хотели найти пороговые значения регионарного насыщения кислородом, которые позволят спрогнозировать нарушение функции органа.
Методы: Были зарегистрированы и проанализированы интраоперационные показатели регионарного насыщения кислородом у 30 пациентов, которые перенесли операцию на дуге аорты. Послеоперационные осложнения были разделены на "тяжёлые" и "лёгкие". Были получены данные о тяжелых нежелательных явлениях, времени экстубации, длительности нахождения на отделении интенсивной терапии, а длительности госпитализации, эти данные сравнивали с интегральными показателями регионарного насыщения кислородом и времени (площади ниже порогового значения) ниже предопределенных абсолютных пороговых значений.
Результаты: Двадцати пациентам было выполнено протезирование нижней части дуги аорты, а 10 пациентам было выполнено полное протезирование дуги аорты. Было выявлено 30 тяжёлых и 29 лёгких осложнений. У шестнадцати пациентов (53.3%) было отмечено, по крайней мере, 1 тяжёлое осложнение. Логистическая регрессия показала статистически выраженную взаимосвязь между площадью ниже порогового значения и частотой тяжелых нежелательных явлений в отношении пороговых значений регионарного насыщения кислородом 60% (P= .038) и 65% (P= .025). Пациенты, которые провели более 30 минут под абсолютным порогом 60%, оставались в стационаре на 4 дня дольше, что вызвало дополнительные затраты в размере 8300,00$.
Выводы: Наши результаты служат доказательством взаимосвязи между снижением периоперационных значений оксигенации головного мозга и неблагоприятными исходов после операции на дуге аорты. (Журнал торакальной и сердечнососудистой хирургии 2010;-:1-7)
Хирургическое восстановление дуги аорты остается технически сложным вмешательством, которое связано с осложненным течением и высокой летальностью. Длительное экстракорпоральное кровообращение (ЭКК), риск эмболии и прерывание мозгового кровотока является неотъемлемыми компонентами этих процедур. В результате этого неврологические и нейропсихологические осложнения встречаются при операциях на дуге аорты чаще, чем при операциях на коронарных сосудах и на клапанах сердца; сообщается о частоте инсульта в диапазоне от 6% до 13%1, а нейропсихологические нарушения встречаются ещё чаще.2
Для неинвазивного мониторинга оксигенации головного мозга использовалась технология спектроскопии в ближней инфракрасной области, при этом её результаты могут иметь прогностическое значение в отношении нежелательных неврологических явлений. Murkin с коллегами3 осуществляли мониторинг результатов спектроскопии в ближней инфракрасной области, а также мониторинг целевой терапии, чтобы оптимизировать насыщение кислородом ткани головного мозга (SctO2) у пациентов, которые перенесли операцию шунтирования коронарной артерии.
Они обнаружили, что в той группе пациентов, в которой использовалась целевая терапия, направленная на поддержание значений SctO2 в пределах 25% от начальных показателей, было отмечено значительно улучшение композитных значений.
В качестве средства мониторинга абсолютного значения SctO2 была принята недавно разработанная технология спектроскопии в ближней инфракрасной области с использованием методики оценки ткани головного мозга с помощью 4 длин волн.4 Потенциальное преимущество абсолютной оксигенации ткани головного мозга состоит в том, что пороговые значения могут быть тесно связаны с нежелательными явлениями. Мы выдвинули гипотезу о том, что величина и продолжительность снижения интраоперационного показателя SctO2 была связана с послеоперационной дисфункцией органа после операции на дуге аорты. Помимо этого, мы пытались идентифицировать пороговые значения SctO2, которые являются прогностически значимыми для дисфункции органа.
МЕТОДЫ
После получения разрешения экспертного совета организации и информированного согласия 31 пациенту была выполнена селективная торакоаортальная операция с остановкой кровообращения в условиях глубокой гипотермии (DHCA) с антероградной селективной перфузией головного мозга (СПГМ) или без неё, при этом проводился интраоперационный мониторинг с помощью церебрального оксигемометра FORESIGHT (CAS Medical Systems, Branford, Conn), данная оценка проводилась в нашем учреждении с 2005 по 2008 год (Рисунок 1).
После вводного наркоза на лоб пациента с двух сторон было установлено 2 датчика для непрерывного мониторинга SctO2. Значения SctO2 регистрировали каждые 2 секунды, начиная с вводного наркоза до конца операции. В течение всего интраоперационного периода для левого и правого датчиков вычислялись минуты SctO2, а также площадь ниже порогового значения (ПНПГ), расположенная ниже абсолютных пороговых пределов 50%, 55%, 60%, и 65%.
| Сокращения и акронимы ПНПГ = площадь ниже порогового значения ЭКК = экстракорпоральное кровообращение DHCA = остановка кровообращения в условиях глубокой гипотермии ОИТ = отделение интенсивной терапии ДП = длительность пребывания ТНЯ = тяжелые нежелательные явления СПГМ = селективная перфузия головного мозга SctO2 = насыщенность ткани головного мозга кислородом TUT = время ниже порогового значения |
На Рисунке 2 показана ПНПГ, ПНПГ вычисляется с помощью данной формулы: ПНПГ (текущая) = ПНПГ (в прошлом) + (порог SctO2 – значение SctO2) X частоту выборки
Осложнения разделили на "тяжёлые" и "лёгкие". К тяжёлым осложнениям отнесли смерть, инсульт со стойкими неврологическими нарушениями на момент выписки, новый случай нарушения функции миокарда (представляет собой снижение фракции изгнания левого желудочка > 20% от дооперационных значений), дыхательная недостаточность (представляет собой зависимость от аппарата искусственной вентиляции лёгких в течение > 3 дней или повторная интубация), сепсис, делирий, новый случай почечной недостаточности (подразумевает необходимость почечной заместительной терапии после операции), осложнение со стороны желудочно-кишечного тракта (ишемия или кровотечение, требующие вмешательства), а также тяжелая объёмная перегрузка (представляет собой прибавку в весе > 20 кг по отношению к весу до операции). Лёгкие осложнения или отсутствие осложнений – новый случай фибрилляции предсердий, незначительная объёмная перегрузка (представляет собой прибавку в весе 10-20 кг по отношению к весу до операции), флебит или отсутствие осложнений.
Была собрана информация о послеоперационных осложнениях, времени экстубации, длительности пребывания (ДП) в отделении интенсивной терапии (ОИТ), а также ДП в стационаре, эти данные сравнивали с данными SctO2 и временем DHCA.
Осложнения разделили на "тяжёлые" и "лёгкие". К тяжёлым осложнениям отнесли смерть, инсульт со стойкими неврологическими нарушениями на момент выписки, новый случай нарушения функции миокарда (представляет собой снижение фракции изгнания левого желудочка > 20% от дооперационных значений), дыхательная недостаточность (представляет собой зависимость от аппарата искусственной вентиляции лёгких в течение > 3 дней или повторная интубация), сепсис, делирий, новый случай почечной недостаточности (подразумевает необходимость почечной заместительной терапии после операции), осложнение со стороны желудочно-кишечного тракта (ишемия или кровотечение, требующие вмешательства), а также тяжелая объёмная перегрузка (представляет собой прибавку в весе > 20 кг по отношению к весу до операции). Лёгкие осложнения или отсутствие осложнений – новый случай фибрилляции предсердий, незначительная объёмная перегрузка (представляет собой прибавку в весе 10-20 кг по отношению к весу до операции), флебит или отсутствие осложнений.
Была собрана информация о послеоперационных осложнениях, времени экстубации, длительности пребывания (ДП) в отделении интенсивной терапии (ОИТ), а также ДП в стационаре, эти данные сравнивали с данными SctO2 и временем DHCA.
Анестезия и мониторинг
После начала использования стандартных мониторов Американского общества анестезиологов, вводный наркоз у всех пациентов осуществляется с помощью этомидата, фентанила и мидазолама. Нервно-мышечная блокада перед интубацией трахеи достигается с помощью векурония или цис-атракурия. Для поддержания наркоза использовалась сбалансированная анестезиологическая методика, включающая изофлюран (концентрация в конце спокойного выдоха 0.6%-1.5%), фентанил, векуроний или цис-атракурий, и мидазолам. Всем пациентам проводилась искусственная вентиляция лёгких при концентрации кислорода 100% с контролем давления и объёма, чтобы поддерживать PaCO2 в диапазоне 35 - 45 мм рт.ст. Мониторинг и контроль основных показателей состояния организма осуществлялся в соответствии с наилучшей клинической практикой на усмотрение анестезиолога. Всех пациентов после окончания операции переводили в кардиоторакальное ОИТ для дальнейшего клинического ведения, при этом пациенты на момент перевода находились в состоянии общей анестезии.
Были установлены следующие мониторы: катетер в левой лучевой артерии, катетер в лёгочной артерии, установленный через правую внутреннюю яремную вену, 20-й яремный катетер для периодического забора крови из яремной вены, а также катетер в мочевом пузыре с интегрированным температурным термистром (для измерения внутренней температуры). Всем пациентам была выполнена чреспищеводная эхокардиография.
Всем пациентам в соответствии с протоколом данного учреждения производилось болюсное введение глюкокортикоидов после вводного наркоза (метилпреднизолон 30 мг/кг). Все пациенты получали либо эпсилон-аминокапроновую кислоту, либо апротинин. Эпсилон-аминокапроновая кислота вводилась в виде болюсов по 150 мг/кг, после чего выполнялась инфузия (15 мг•кг-1•ч-1) в течение всего срока. Апротинин вводили в соответствии с протоколом Hammersmith.5
В ходе операции пациенты оставались в положении лёжа на спине, при этом допускались лишь позиционные изменения, которые облегчали хирургический доступ. При этом не было отмечено никаких изменений в хирургической технике или стандартном клиническом мониторинге.
Хирургическая техника
Всем пациентам была выполнена катетеризация в правой подмышечной зоне, что описано Strauch с соавторами.6 После стернотомии, отделения сердца и крупных сосудов в правое предсердие была установлена 2-этапная канюля для венозного оттока.
В это исследование вошли две подгруппы пациентов, требующих селективной торакальной операции на дуге аорты. Пациентам первой группы была необходима замена всей дуги аорты. Используемая техника подробно описана Spielvogel и его коллегами.7 Мы дадим краткое описание: после начала экстракорпорального кровообращения пациентов охлаждали до температуры носоглотки 12°C-15°C с использованием alpha-stat. Ишемическую остановку кровообращения в условиях глубокой гипотермии начинали только тогда, когда были выполнены все вышеупомянутые критерии. На время остановки кровообращения к главным сосудам пришивали трифуркационный трансплантат. После того, как были выполнены все 3 анастомоза, выполнялось удаление воздуха из трансплантата, а его проксимальный конец зажимался. Через правую подмышечную артерию начиналась антеградная селективная перфузия головного мозга (10 мл/кг идеальной массы тела в минуту) после 15 - 45 минут ишемической DHCA. Для СПГМ использовался трубчатый трансплантат, с помощью которого выполнялось соединение патологически неизмененной части восходящей аорты с проксимальным концом нисходящей аорты. Впоследствии, трифуркационный трансплантат пришивали к трубчатому аортальному трансплантату. После тщательного удаления воздуха начиналась перфузия всего тела с повторным обогревом пациента.
Другая группа состояла из пациентов, требующих протезирования восходящей аорты с косой линией шва в области дуги (процедура протезирования нижней части дуги аорты). Эта техника детально описана Etz с соавторами.8 Короче говоря, техника ЭКК и температурного контроля при ЭКК идентичны тем, которые были описаны для полного протезирования дуги аорты. Проксимальный анастомоз выполнен с пережатием аорты. Как только анастомоз будет завершён, и будут выполнены все критерии остановки кровообращения (температура 12°C-15°C, насыщение кислородом ярёмной вены > 94%, и минимальное время охлаждения 45 минут), выполняется остановка кровообращения для выполнения дистального анастомоза. По окончанию было восстановлено кровообращение во всём теле, и выполнен обратный нагрев пациента. Для данной методики СПГМ не требуется.
Хирургическая техника
Всем пациентам была выполнена катетеризация в правой подмышечной зоне, что описано Strauch с соавторами.6 После стернотомии, отделения сердца и крупных сосудов в правое предсердие была установлена 2-этапная канюля для венозного оттока.
В это исследование вошли две подгруппы пациентов, требующих селективной торакальной операции на дуге аорты. Пациентам первой группы была необходима замена всей дуги аорты. Используемая техника подробно описана Spielvogel и его коллегами.7 Мы дадим краткое описание: после начала экстракорпорального кровообращения пациентов охлаждали до температуры носоглотки 12°C-15°C с использованием alpha-stat. Ишемическую остановку кровообращения в условиях глубокой гипотермии начинали только тогда, когда были выполнены все вышеупомянутые критерии. На время остановки кровообращения к главным сосудам пришивали трифуркационный трансплантат. После того, как были выполнены все 3 анастомоза, выполнялось удаление воздуха из трансплантата, а его проксимальный конец зажимался. Через правую подмышечную артерию начиналась антеградная селективная перфузия головного мозга (10 мл/кг идеальной массы тела в минуту) после 15 - 45 минут ишемической DHCA. Для СПГМ использовался трубчатый трансплантат, с помощью которого выполнялось соединение патологически неизмененной части восходящей аорты с проксимальным концом нисходящей аорты. Впоследствии, трифуркационный трансплантат пришивали к трубчатому аортальному трансплантату. После тщательного удаления воздуха начиналась перфузия всего тела с повторным обогревом пациента.
Другая группа состояла из пациентов, требующих протезирования восходящей аорты с косой линией шва в области дуги (процедура протезирования нижней части дуги аорты). Эта техника детально описана Etz с соавторами.8 Короче говоря, техника ЭКК и температурного контроля при ЭКК идентичны тем, которые были описаны для полного протезирования дуги аорты. Проксимальный анастомоз выполнен с пережатием аорты. Как только анастомоз будет завершён, и будут выполнены все критерии остановки кровообращения (температура 12°C-15°C, насыщение кислородом ярёмной вены > 94%, и минимальное время охлаждения 45 минут), выполняется остановка кровообращения для выполнения дистального анастомоза. По окончанию было восстановлено кровообращение во всём теле, и выполнен обратный нагрев пациента. Для данной методики СПГМ не требуется.
DHCA
(остановка кровообращения в условиях глубокой гипотермии )
Техника DHCA, используемой в нашем учреждении, оставалась постоянной в течение всего исследования и была подробно описана выше. Перед остановкой кровообращение допускалось минимум 45 минут охлаждения. Адекватное охлаждение головного мозга было обеспечено во всех случаях путём насыщения крови в ярёмной вене до более чем 94% и при температуре носоглотки 12°C - 15°C. У всех тех пациентов, которым планировалось проведение более 20 минут DHCA или использовалась СПГМ, голову обкладывали льдом.
Перфузионный нагрев выполнялся в конце процедуры, при этом градиент между температурой пищевода и температурой крови поддерживался на уровне менее 10°C. Нагрев продолжался, пока температура пищевода не достигала 35°C, а температура мочевого пузыря не поднималась выше 32°C. Нагрев обычно достигался через 1 час перфузии.
Перфузия
При ЭКК (экстракорпоральном кровообращении) поддерживалась скорость потока на уровне 2.0 - 2.6 Л • мин-1 • м-2, с корректировкой до полной метаболической потребности каждого конкретного пациента. Последовательно выполнялась лактатная процедура и смешанная венозная оксигенация. Защита миокарда выполнялась с помощью холодовой антеградной кардиоплегии. У больных с тяжелой ишемической болезнью сердца использовалась также ретроградная кардиоплегия. Кардиоплегический раствор вводили каждые 20 - 30 минут во время периодов ишемии миокарда. Управление температурой пациента осуществлялось лечащим хирургом. Охлаждение выполнялось под контролем alpha-stat. Контуры ЭКК были оснащены фильтром на артериальной линии с размером пор 40 мкм, оксигенатором с поверхностно-немодифицированной мембраной, а также встроенным венозным резервуаром и резервуаром для кардиотомии, при этом объём первичного раствора составлял 1600 мл. Первичный раствор состоял из раствора PlasmaLyte (Baxter Healthcare Corporation, Deerfield, Ill), 50 мЭкв NaHCO3, 12,5 грамм маннитола и 10 000 U нефракционированного гепарина.
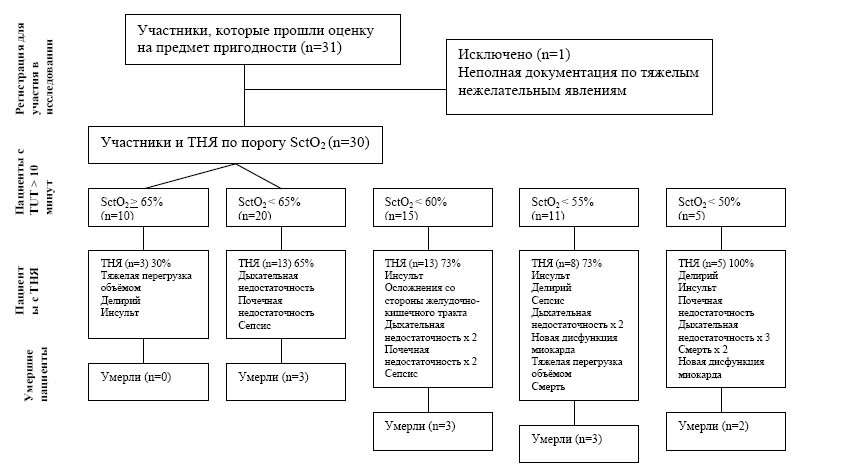
РИСУНОК 1. Общая схема, в которую вошёл 31 пациент, перенесшие селективную торакальную операцию на аорте с остановкой кровообращения в условиях глубокой гипотермии (DHCA). ТНЯ, Тяжелые нежелательные явления; SctO2, насыщение ткани головного мозга кислородом.
Статистика
В ходе сравнения 2 групп использовались точные критерии Фишера для категорических переменных, а также критерии Стьюдента t или непараметрические критерии Уилкоксона для непрерывных переменных, в зависимости от ситуации. Для оценки взаимосвязи между временем воздействия и тяжелыми нежелательными явлениями (ТНЯ), которые представляли собой наличие, по крайней мере, 1 тяжёлого осложнения после операции, использовалась логистическая регрессия с учётом возраста.
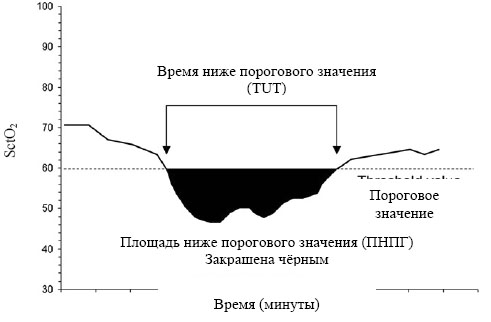
РИСУНОК 2. Площадь ниже порогового значения (ПНПГ). ПНПГ (в настоящее время) = ПНПГ (в прошлом) + (Порог SctO2 – значение SctO2) х частоту выборки. SctO2, Насыщение ткани головного мозга кислородом.
Влияние времени воздействия выражено в виде относительного риска. Из-за небольшого размера выборки, использовались доверительные интервалы вероятности. Также было показано, что с-статистическая величина, также известная как площадь под рабочей характеристической кривой, указывает на прогнозируемость получения ТНЯ, при этом в качестве прогностических факторов использовался возраст и время воздействия. Из-за ограниченного числа ТНЯ, в модели не учитывались никакие другие ковариаты. Для оценки взаимосвязи между временем воздействия, площадью ниже порогового значения SctO2 временем экстубации, временем нахождения в ОИТ, и ДП в стационаре использовались коэффициенты корреляции Спирмена. Мы выполнили анализ чувствительности, чтобы оценить, какое влияние оказывают смертельные случаи на связь между результатами для стационара и SctO2. Предположение в данном случае заключается в том, что ДП в больнице было бы дольше, если бы не произошла смерть. Первый анализ установил максимальное значение ДП для исследования (=102 дня) для экстубации/ОИТ/ДП в больнице для всех 3 смертельных случаев. Второй анализ установил среднюю ДП в больнице для группы ТНЯ (=13 дней) для времени экстубации/длительности пребывания в ОИТ/длительности пребывания в больнице в днях для 1 пациента, который умер до 13 дня. Последний анализ был основан на оригинальных данных. Все статистические исследования были выполнены с использованием SAS (SAS Institute, Inc, Cary NC). У авторов был полный доступ к данным.
РЕЗУЛЬТАТЫ
Были собраны общие послеоперационные данные для 30 пациентов. Один пациент был исключен из исследования вследствие недостаточного количества послеоперационной документации.
ТАБЛИЦА 1. Популяционная демография, интраоперационные и послеоперационные результаты
| Переменная | Среднее значение (SD – среднеквадратичное отклонение) или медиана (IQR – межквартильный размах) |
| Вес (кг) | 86.0 (23.5) |
| Рост (см) | 176.4 (9.1) |
| Площадь поверхности (м2) | 2.0 (0.3) |
| Возраст (лет) | 68.7 (12.1) |
| Мужчины (%) | 73% |
| Европеоидные (%) | 83% |
| Гематокрит до остановки кровообращения (%) | 26.2 (4.2) |
| Температура при остановке кровообращения (°C) | 13.6 (1.9) |
| DHCA (мин) | 24.7 (8.0) |
| pH | 7.4 (0.1) |
| PaCO2 (мм рт.ст.) | 43.2 (6.9) |
| PaO2 (мм рт.ст.)* | 318.5 (264.0, 379.0) |
| Время экстубации (d)* | 1.5 (1, 4.0) |
| Пребывание в ОИТ (d)* | 4.0 (3.0, 8.0) |
| Длительность госпитализации (d)* | 10.0 (7.0, 14.0) |
________________
SD, Cреднеквадратичное отклонение; IQR, межквартильный размах, который представляет собой диапазоном между 25 и 75 процентилями; DHCA, остановка кровообращения в условиях глубокой гипотермии; ОИТ, отделение интенсивной терапии.
*Медиана и IQR использовали при отсутствии нормального распределения данных.
Демографические данные, а также интраоперационная и послеоперационная информация для этих 30 пациентов показаны в Таблице 1. Двадцати пациентам было выполнено протезирование восходящей аорты, включая протезирование нижней части дуги аорты, а 10 пациентам было выполнено полное протезирование дуги аорты. На рисунке 3 показана послеоперационная SctO2. Только у 21 пациента было отмечено плато температуры на уровне 20°C перед началом охлаждения до температуры остановки. Ещё 9 пациентов охлаждали непосредственно до температуры остановки. У этих 30 пациентов было идентифицировано 30 тяжёлых и 29 лёгких осложнений (Таблица 2). У шестнадцати пациентов (53.3%) было отмечено, по крайней мере, 1 тяжёлое осложнение, у 8 (26.6%) было, по крайней мере, 1 лёгкое осложнение, и у 6 (20%) не было никаких осложнений. В рамках данного анализа мы дали следующее определение ТНЯ - наличие 1 или нескольких выраженных послеоперационных осложнений. При этом не было обнаружено никаких статистически значимых различий между пациентами с ТНЯ в отношении возраста, пола, роста, гематокрита до остановки, температуры во время DHCA, а также PaCO2. Пациенты, у которых были отмечены ТНЯ, весили меньше (среднее значение ± SD, 77.8 ± 17.0 кг для ТНЯ и 95.4 ± 26.8 кг для пациентов без ТНЯ; разница [95% доверительный интервал, 17.5 кг (0.3-35.8 кг); P =.047]), и имели меньшую площадь поверхности тела (1.9 ± 0.2 м. для ТНЯ и 2.1 ± 0.3 м2 для пациентов без ТНЯ; разница [95% доверительный интервал]: 0.2 (0.0 - 0.4) м2; P = 0.046]).
У восьми (27%) пациентов значения SctO2 не опускались ниже 65%. У каждого из оставшихся 22 пациентов, у которых SctO2 было ниже 65% также было отмечено снижение SctO2 до уровня менее 60%. У девятнадцати пациентов SctO2 было менее 55%, а у 12 пациентов SctO2 было 50%. Интегральные показатели SctO2 под конкретными пороговыми значениями (ПНПГ) в зависимости от времени представлены в Таблице 3. Медиана времени воздействия для SctO2 ниже 50%, 55%, 60% и 65% составила 4, 12, 29 и 128 минут, соответственно. Помимо этого у 19 пациентов, у которых SctO2 было ниже 55%, медиана времени, в течение которого SctO2 находилось в диапазонах 60% - 65%, 55% - 60% и 50% - 55% составила 50, 25 и 9 минут, соответственно.
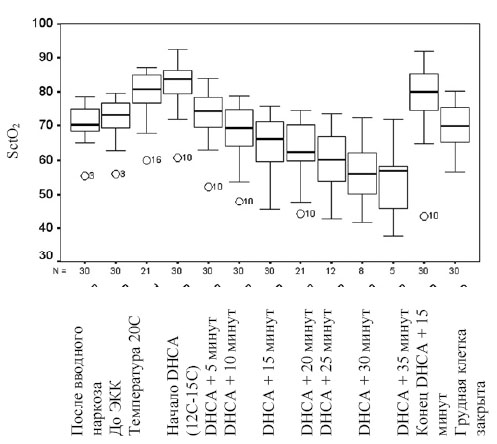
РИСУНОК 3. Распределение во времени значений SctO2 в послеоперационном периоде. Итоговая коробчатая диаграмма основана на медианах, квартилях и крайних значениях SctO2 . Коробка представляет собой межквартильный размах, который содержит 50% значений SctO2 . «Усы» - линии, которые отходят от коробки к самым высоким и самым низким значениям SctO2, кроме резко выделяющихся значений. Линия, проходящая через коробку, представляет собой медиану. Значения SctO2, которые указаны на коробчатой диаграмме, представляют собой средние значения, полученные с левого и правого лобных датчиков оксиметрии головного мозга. Условные обозначения: После вводного наркоза, SctO2 сразу после установки датчиков на голову в ходе вводного наркоза; Перед СРВ, SctO2 за 2 минуты до начала ЭКК; Температура 20С, плато SctO2 для пациентов с начальной гипотермией до 20°C; Начало DHCA, максимальное значение SctO2 во время глубокой гипотермии непосредственно перед началом DHCA; DHCA +5 минут, SctO2 спустя 5 минут после начала DHCA; DHCA +10 минут, SctO2 спустя 10 минут после начала DHCA; DHCA + 15 минут, SctO2 спустя 15 минут после начала DHCA; DHCA +20 минут, SctO2 спустя 20 минут после начала DHCA; DHCA +25 минут, SctO2 спустя 25 минут после начала DHCA; DHCA +30 минут, SctO2 спустя 30 минут после начала DHCA; DHCA +35 минут, SctO2 спустя 35 минут после начала DHCA; Конец DHCA +15 минут, SctO2 спустя 15 минут после DHCA; Грудная клетка закрыта, SctO2 сразу после окончания операции. N - количество пациентов из 30, у которых было каждое из указанных явлений; SctО2, Насыщение ткани головного мозга кислородом.
РИСУНОК 3. Распределение во времени значений SctO2 в послеоперационном периоде. Итоговая коробчатая диаграмма основана на медианах, квартилях и крайних значениях SctO2 . Коробка представляет собой межквартильный размах, который содержит 50% значений SctO2 . «Усы» - линии, которые отходят от коробки к самым высоким и самым низким значениям SctO2, кроме резко выделяющихся значений. Линия, проходящая через коробку, представляет собой медиану. Значения SctO2, которые указаны на коробчатой диаграмме, представляют собой средние значения, полученные с левого и правого лобных датчиков оксиметрии головного мозга. Условные обозначения: После вводного наркоза, SctO2 сразу после установки датчиков на голову в ходе вводного наркоза; Перед СРВ, SctO2 за 2 минуты до начала ЭКК; Температура 20С, плато SctO2 для пациентов с начальной гипотермией до 20°C; Начало DHCA, максимальное значение SctO2 во время глубокой гипотермии непосредственно перед началом DHCA; DHCA +5 минут, SctO2 спустя 5 минут после начала DHCA; DHCA +10 минут, SctO2 спустя 10 минут после начала DHCA; DHCA + 15 минут, SctO2 спустя 15 минут после начала DHCA; DHCA +20 минут, SctO2 спустя 20 минут после начала DHCA; DHCA +25 минут, SctO2 спустя 25 минут после начала DHCA; DHCA +30 минут, SctO2 спустя 30 минут после начала DHCA; DHCA +35 минут, SctO2 спустя 35 минут после начала DHCA; Конец DHCA +15 минут, SctO2 спустя 15 минут после DHCA; Грудная клетка закрыта, SctO2 сразу после окончания операции. N - количество пациентов из 30, у которых было каждое из указанных явлений; SctО2, Насыщение ткани головного мозга кислородом.
Несмотря на то, что только у 33% пациентов, у которых насыщение крови кислородом не опускалось ниже SctO2 65% более чем на 10 минут, имели место ТНЯ, это количество резко выросло до 67% у тех пациентов, у которых насыщение опускалось ниже указанных значений. У всех пациентов со значениями SctO2 ниже 50% в течение, по крайней мере, 10 минут были отмечены ТНЯ.
Для оценки взаимосвязи между ТНЯ и временем воздействия SctO2 ниже данного порогового значения (TUT) использовалась логистическая регрессия с контролем по возрасту (Таблица 4). Была обнаружена статистически значимая взаимосвязь между частотой TUT и ТНЯ для пороговых значений SctO2 60% (P =.038) и 65% (P =.025). На рисунке 4 показан относительный риск с 95% доверительными интервалами для ТНЯ с нарастающим временем воздействия по значениям SctO2 при конкретных пороговых значениях. Для каждого 5% снижения абсолютного порога SctO2, возрастающее время воздействия до достижения указанного относительного риска (для ТНЯ) было снижено наполовину для пороговых значений SctO2 в диапазоне от 55% до 65%. Прогнозирующие значения (c-статистическая величина) TUT для ТНЯ (с учётом возраста) составили 0.77, 0.81 и 0.83 для пороговых значений SctO2 55, 60 и 65% соответственно. В старшем возрасте была продемонстрирована более или менее значительная прогностическая тенденция в отношении ТНЯ (0.05 <P <.1 для всех 3 пороговых моделей). Вероятность наличия ТНЯ увеличивалась примерно в два раза на каждые 10 лет возраста.
ТАБЛИЦА 2. Осложнения
| Тяжёлые осложнения | Пациенты с осложнениями |
| Смерть | 3 (10%) |
| Инсульт | 3 (10%) |
| Впервые выявленная дисфункция миокарда | 2 (6.7%) |
| Дыхательная недостаточность | 8 (26.7%) |
| Сепсис 3 | (10%) |
| Делирий | 4 (13.4%) |
| Почечная недостаточность, требующая диализа | 4 (13.4%) |
| Осложнения со стороны желудочно-кишечного тракта, требующие вмешательства | 1 (3.3%) |
| Тяжелая перегрузка объемом, отёк | 2 (6.7%) |
| Лёгкое осложнение или их отсутствие | |
| Фибрилляция предсердий | 13 (44.8%) |
| Незначительная перегрузка объемом | 7 (24.1%) |
| Флебит | 3 (10.3%) |
| Нет | 6 (20.7%) |
На основе этих результатов мы оценили взаимосвязь между продолжительностью времени воздействия, ПНПГ и курсом лечения в стационаре. Мы использовали 3 метода анализа, которые позволяли по разному учитывать смертельные случаи (см. раздел «Методы», в котором приведена более детальная информация). Было сделано предположение о том, что ДП в больнице была дольше, чем та, которая отмечалась при смертельных случаях. В целом коэффициент корреляции Спирмена указал на положительную взаимосвязь между временем и ПНПГ для периода экстубации, пребывания в ОИТ и ДП в больнице (Таблица 5). В частности во всех 3 исследованиях пациенты с большей продолжительностью низкого уровня SctO2, которые отражают более высокие интегральные показатели низкого SctO2 во времени для пороговых значений SctO2 65% и 60%, с более высокой степенью вероятности будут иметь более длительную послеоперационную искусственную вентиляцию легких и большую ДП в ОИТ. Для ДП в больнице была показана та же самая тенденция, что и для времени экстубации и для ДП в ОИТ, но она потеряла своё значение, когда использовались оригинальные данные. Пороговые значения SctO2 55% показали немного более низкие корреляции, - это стало результатом того, что всё меньшее количество пациентов проводило своё время ниже этого порогового значения (таким образом, была получена большая группа нолей для времени и ПНПГ).
Наконец, мы исследовали финансовое бремя в нашем учреждении, которые было напрямую вызвано длительным временем пребывания в ОИТ и в больнице.
ТАБЛИЦА 3. Время воздействия и площадь под пороговыми значениями SctO2
| SctO2 (%) | N (%) | Медиана (диапазон) | |
| Время (минуты) | ПНПГ (% - мин) | ||
| SctO2<50% | 12 (40%) | 4.0 (0.1, 263.0) | 6.7 (0.2, 1973.8) |
| SctO2 <55% | 19 (63%) | 11.7 (0.2, 363.1) | 29.0 (0.1, 3575.4) |
| SctO2 <60% | 22 (73%) | 28.5 (0.7, 425.0) | 117.6 (1.1, 5544.9) |
| SctO2 <65% | 22 (73%) | 28.1 (2.7, 486.9) | 1 382.9 (14.3, 7829.4) |
SctO2, Насыщение кислородом ткани головного мозга; ПНПГ, площадь ниже порогового значения.
ТАБЛИЦА 4. Модели логистической регрессии для взаимосвязи между ТНЯ и временем ниже порогового значения SctO2 (TUT) 55%, 60% и 65%, с учётом возраста
|
Модель |
Параметр |
Оценочное значение коэффициента |
Стандартная ошибка |
Значение P |
|
SctO2 < 55% |
Отрезок на оси |
-4.898 |
2.795 |
.080 |
|
|
TUT (мин) |
0.061 |
0.039 |
.117 |
|
|
Возраст (лет) |
0.063 |
0.038 |
.098 |
|
SctO2 < 60% |
Отрезок на оси |
-6.047 |
3.116 |
.052 |
|
|
TUT (мин) |
0.034 |
0.016 |
.038 |
|
|
Возраст (лет) |
0.074 |
0.042 |
.077 |
|
SctO2 < 65% |
Отрезок на оси |
-5.693 |
3.045 |
.063 |
|
|
TUT (мин) |
0.016 |
0.007 |
.025 |
|
|
Возраст (лет) |
0.067 |
0.040 |
.096 |
Вероятность ТНЯ составляет Pr (ТНЯ) = , где exp () представляет собой экспоненциальную функцию, а у вычисляется с использованием приведённых выше ?-коэффициентов. Например, у 70-летнего пациента, у которого имело место более 30 минут SctO2 ниже 65%, у = - 5.693 + 0:016 х TUT + 0.067 х возраст = -5.693+0.016 х 30 + 0.067 х 70 = -0.523. При этом Pr (ТНЯ) = 0.37. ТНЯ, Тяжелое нежелательное явление; SctО2, насыщение кислородом ткани головного мозга.
Чтобы проиллюстрировать данную ситуацию мы использовали прогностическую модель у пациентов, которые провели более 30 минут ниже порогового значения SctO2 60% в противоположность пациентам, у которых такого не отмечалось. Была спрогнозирована медиана ДП на 3 дня дольше (6 и 3) в ОИТ, а общий срок пребывания в стационаре был на 4 дня дольше (13 против 9), из которых 2 дня были связаны с нахождением в ОИТ, а 1 не был связан с пребыванием в ОИТ. Общая стоимость этого дополнительного пребывания составила 8300,00$ для нашей больницы, при этом для расчёта мы использовали финансовые показатели для стационарного хирургического лечения в кардиологическом отделении.
ОБСУЖДЕНИЕ
Сниженные значения SctO2 связаны с тяжёлыми осложнениями, длительной послеоперационной искусственной вентиляции легких, а также с длительным сроком пребывания в ОИТ и в больнице. При этом самый низкий уровень SctO2 и интегральный показатель низкого SctO2 со временем были связаны с тяжелыми нежелательными результатами. Каждое дополнительное десятилетие жизни было связано с удвоением риска ТНЯ.
Текущее исследование не первое, в котором было указано на взаимосвязь между значениями оксиметрии головного мозга и клиническими результатами в послеоперационном периоде. В одной из последних работ Murkin с коллегами3 было показано снижение уровня ДП у больных, которым выполнялось шунтирование коронарной артерии, когда с помощью готового протокола проводилась терапия эпизодов со снижением SctO2. Slater с коллегами9 обнаружили, что пациенты с длительным снижением SctO2, которым выполнялось шунтирование коронарной артерии, имели более высокую частоту ранней послеоперационной нейрокогнитивной дисфункции и более длительный срок пребывания в больнице. Casati с коллегами10 указали на сокращение периода нахождения в посленаркозной палате, а также на сокращение ДП на отделении абдоминальной хирургии, когда пациенты получали активное лечение для поддержания SctO2 на уровне выше 75% от начальных значений с использованием установленного алгоритма. В ходе предыдущих исследований также удалось идентифицировать гериатрическую возрастную группу в качестве независимого фактора риска ранней смертности в комплексе хирургии сердца.11,12
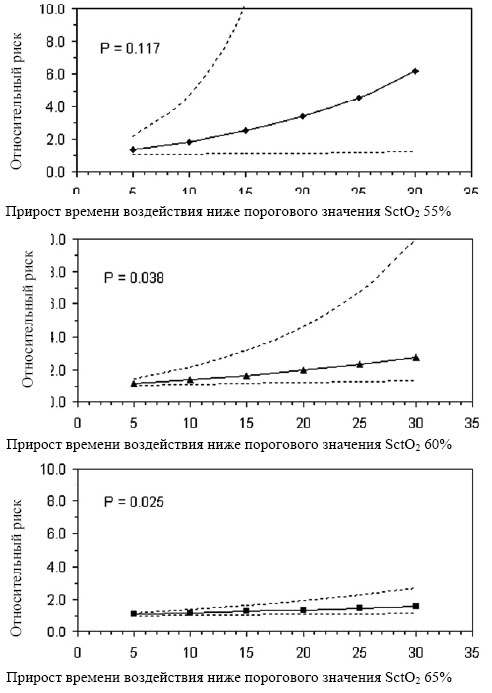
РИСУНОК 4. Показатели относительного риска ТНЯ для растущего времени воздействия SctO2 ниже конкретных пороговых значений. Для каждого 5% снижения абсолютного порога SctO2, прирост времени воздействия до достижения данного относительного риска (для ТНЯ) уменьшается наполовину для пороговых значений SctO2 в диапазоне от 55% до 65%. C-статистические данные времени ниже порогового значения для ТНЯ были 0.77, 0.81 и 0.83 для пороговых значений SctO2 55, 60, и 65%, соответственно. Вероятность наличия ТНЯ увеличивается примерно в два раза на каждые 10 лет возраста.
ТНЯ, Тяжелое нежелательное явление; SctO2, насыщение кислородом ткани головного мозга.
Это соответствует общим результатом в отношении того, что пожилой возраст связан с потерей резерва органов мишеней.13
Это было проспективное обсервационное исследование. И, несмотря на статистически значимые связи, неизвестно, предотвратят ли вмешательства, направленные на рост SctO2,, нежелательные явления. Помимо этого, структура интраоперационного ведения со временем меняется. Один пример из текущего исследования: в ходе набора пациентов в исследование из клинической практики был изъят апротинин, и для некоторого числа пациентов стало невозможным проведение анализа этой переменной. В это исследование вошли только те пациенты, которым выполнялась операция на дуге аорты, а мониторинг SctO2 проводился только в течение интраоперационного периода.
ТАБЛИЦА5. Коэффициенты корреляции Спирмена (rs) для пороговых значений SctO2 и послеоперационных результатов в стационаре
| Время экстубации | Пребывание в ОИТ | Пребывание в больнице | ||||
| SctO2 (%) | rs | значение Р | rs | значение Р | rs | значение Р |
| <65% (мин) | 0.53*,1 | .002 | 0.58* | <.001 | 0.49* | .006 |
| 0.53*,1 | .002 | 0.57* | <.001 | 0.41* | .024 | |
| 0.53*,1 | .004 | 0.51* | .004 | 0.27 | .149 | |
| <60% (мин) | 0.48* | .008 | 0.50* | .005 | 0.44* | .015 |
| 0.47* | .008 | 0.49* | .006 | 0.37* | .046 | |
| 0.45* | .013 | 0.42* | .020 | 0.23 | .222 | |
| <55% (мин) | 0.35** | .057 | 0.43* | .019 | 0.40* | .027 |
| 0.35** | .059 | 0.42* | .022 | 0.34** | .070 | |
| 0.32** | .084 | 0.34** | .065 | 0.20 | .300 | |
| <65% ПНПГ (% - мин) | 0.50* | .005 | 0.52* | .003 | 0.45* | .013 |
| 0.50* | .005 | 0.51* | .004 | 0.38* | .041 | |
| 0.47* | .008 | 0.44* | .015 | 0.24 | .207 | |
| <60% ПНПГ (% - мин) | 0.41* | .024 | 0.46* | .010 | 0.39* | .034 |
| 0.41* | .024 | 0.45* | .013 | 0.31** | .091 | |
| 0.38* | .037 | 0.38* | .040 | 0.18 | .346 | |
| <55% ПНПГ (% - мин) | 0.35** | .058 | 0.42* | .020 | 0.39* | .031 |
| 0.35** | .060 | 0.41* | .024 | 0.32** | .090 | |
| 0.32** | .085 | 0.34** | .069 | 0.17 | .350 | |
SctO2, Насыщение кислородом ткани головного мозга; ОИТ, отделение интенсивной терапии; ДП, длительность госпитализации; ПНПГ, площадь ниже порогового значения; ТНЯ, тяжелое нежелательное явление. *P значение <.05 значений **P значение <0.1 (двухстороннее). 1В исследовании умерло 3 пациента; у всех у них было ТНЯ, и они умерли в ОИТ экстубированные. Длительность нахождения в стационаре составила 4, 13 и 102 дня, соответственно. Мы выполнили оценку чувствительности, чтобы оценить, как смерть влияет на взаимосвязь между результатами госпитализации и SctO2. Допущение в данном случае заключается в том, что длительность пребывания в больнице была бы выше, чем наблюдаемая, если бы не произошла смерть. Первый ряд корреляций Спирмена был рассчитан на основе 102 дней (максимальная длительность пребывания в данном исследовании) для времени экстубации/ДП в ОИТ/ ДП в больнице для всех 3 смертельных случаев. Во втором ряду корреляции Спирмена были рассчитаны на основе 13 дней (медиана пребывания в больнице для группы ТНЯ) для времени экстубации/ДП в ОИТ/ ДП в больнице для пациента, который умер на 4 день. В последнем ряду корреляции были основаны на оригинальных данных.
Головной мозг как сторожевой орган
Текущее исследование, а также исследования, процитированные в нём, указывают на эволюцию в интерпретации данных SctO2. И хотя исследователи изначально были нацелены на результаты для головного мозга, возникла гипотеза о том, что мониторинг SctO2 может стать показателем общей перфузии органа и травмы. Наши результаты указывают на то, что статистически значимая модель, использующая данные SctO2, прогнозирующая длительность пребывания в ОИТ и в больнице, даёт заниженную оценку; при этом мы считаем, что в будущих исследованиях можно исследовать экономическую эффективность этой формы мониторинга и вмешательства.
Слишком рано рекомендовать конкретные целевые значения SctO2, которые следует поддерживать в различных клинических учреждениях. Но в качестве первой предварительной оценки, на основе технологии, используемой в данном исследовании, в клинических условиях, характерных для торакальной хирургии аорты, мы полагаем, что данное пороговое значение SctO2 может составлять 60% - 65%.
Суммируя вышесказанное, текущее исследование даёт новые доказательства в поддержку взаимосвязи снижения значения интраоперационного уровня оксигенации и плохих результатов. Предварительные результаты указывают на то, что абсолютные пороговые значения являются прогностическими факторами в отношении нежелательных результатов, а это в свою очередь указывает на необходимость проведения дополнительных исследований после модели Murkin для проспективных интевенционных исследований, в ходе которых будут оцениваться общие послеоперационные результаты.
Библиография
1. Gega A, Rizzo JA, Johnson MH, Tranquilli M, Farkas EA, Elefteriades JA. Прямая остановка кровообращения в условиях глубокой гипотермии: опыт использования у 394 пациентов указывает на эффективность этого метода в качестве единственного средства сохранения структуры головного мозга. Анналы торакальной хирургии 2007; 84:759-66.
2. Reich DL, Uysal S, Sliwinski M, Ergin MA, Kahn RA, Konstadt SN, с соавторами. Нейропсихологические результаты после остановки кровообращения в условиях глубокой гипотермии у взрослых. Журнал торакальной и сердечнососудистой хирургии. 1999; 117:156-63.
3. Murkin JM, Adams SJ, Novick RJ, Quantz М., Bainbridge D, Iglesias I, с соавторами. Мониторинг насыщения кислородом головного мозга во время операции коронарного шунтирования: рандомизированное проспективное исследование. Анестезия и анальгезия. 2007; 104:51-8.
4. CAS Medical Systems. Вебсайт CASMED. Адрес: http://www.casmed.com. Доступ получен 1 сентября 2009 года.
5. Royston D. Высокодозовая терапия апротинином: результаты первых пяти лет использования. Журнал кардиоторакальной и сосудистой анестизиологии. 1992; 6:76-100.
6. Strauch JT, Spielvogel D, Lauten A, Lansman SL, McMurtry K, Bodian CA, с соавторами. Катетеризация подмышечной артерии: рутинный вариант при протезировании восходящей аорты и дуги аорты. Анналы торакальной хирургии 2004; 78:103-8.
7. Spielvogel D, Etz CD , Silovitz D, Lansman SL, Griepp RB. Протезирование дуги аорты с использованием трифуркационого трансплантата. Анналы торакальной хирургии 2007; 83:791-5.
8. Etz CD, Homann TM, Rane N, Bodian CA, Di Luozzo G, Plestis KA, с соавторами. Реконструкция корня аорты с использованием биопротезного клапанного проводника: последовательная серия из 275 процедур. Журнал торакальной и сердечнососудистой хирургии. 2007; 133: 1455-63.
9. Slater JP, Guarino T, Stack J, Vinod K, Bustami RT, Brown JM 3rd, с соавторами. Снижение уровня насыщения кислородом в головном мозге является прогностическим признаком в отношении снижения когнитивной функции и более длительного пребывания в стационаре после операции на сердце. Анналы торакальной хирургии 2009; 87:36-44.
10. Casati A, Fanelli G, Pietropaoli P, Proietti R, Tufano R, Danelli G,, с соавторами. Непрерывный мониторинг насыщения крови кислородом у пожилых пациентов, которым выполняется обширная абдоминальная операция, минимизирует подверженность головного мозга потенциальной гипоксии. Анестезия и анальгезия. 2005; 101:740-7.
11. Maganti M, Rao V, Armstrong S, Feindel CM, Scully HE, David TE. Повторная операция на клапане у пожилых пациентов. Анналы торакальной хирургии 2009; 87:521-5.
12. Chukwuemeka A, Borger MA, Ivanov J, Armstrong S, Feindel CM, David TE. Операция на клапане у восьмидесятилетних пациентов: безопасный вариант с хорошими среднесрочными результатами. Журнал патологии клапанов сердца 2006; 15:191-6.
13. Loran DB, Hyde BR, Zwischenberger JB. Послеоперационное ведение пациентов особых групп: гериатрические пациенты. Журнал клинической хирургии Северной Америки. 2005; 85: 1259-66.000
