Мониторинг тканевой оксигенации: новая краска в палитре анестезиолога?
Быстрый переход:
- Введение
- Методы
- Тканевая оксиметрия. Суть метода и его применение
- Проба с артериальной окклюзией в анализе тканевой оксигенации
- Полученные результаты и их обсуждение
- Выводы
- Список литературы
Введение
Идеология применения тканевой оксигенации для мониторинга гомеостаза во время анестезии имеет длительную историю. В нашем Центре подобная доктрина была реализована еще в 60-х годах прошлого века при становлении методики искусственного кровообращения [1]. Тканевая оксигенация отражает баланс доставки и потребления кислорода тканями и демонстрирует эффективность кислородного транспорта во время анестезии. Однако, этот показатель не нашел широкого применения, что было обусловлено сложностью и дороговизной оборудования. Только в последние годы с внедрением в клиническую практику тканевой оксиметрии (ТО) с помощью близкой по спектру к инфракрасной спектроскопии (БИКС или NIRS в англоязычной литературе) у анестезиологов появилась возможность мониторировать региональную оксигенацию. В настоящее время в клинике для оценки насыщения кислородом тканей головного мозга во время анестезии и при различных состояниях в реаниматологии широко используется церебральная оксиметрия, которая является одним из частных случаев ТО [14,16].
На наш взгляд, большой практический интерес вызывает возможность использования ТО для мониторинга оксигенации периферических (StO2), прежде всего, мышечных тканей [10]. Правомерность такого использования данной методики была доказана как в эксперименте [9,37], так и в клинике [4,7,30]. ТО имеет хорошую воспроизводимость и помимо баланса доставки и потребления кислорода может отражать состояние кровотока в микроциркуляторном русле. В оценке микроциркуляции ТО может превосходить такие устоявшиеся способы оценки кровотока периферических тканей, как радиоизотопная плетизмография [19]. Наиболее часто в анестезиологии и реаниматологии ТО используется при состояниях сопровождающихся выраженными нарушениями микроциркуляции и тканевой перфузии, например при сепсисе [21]. При септическом шоке более низкие показатели StO2 ассоциируются с нарушениями гемодинамики, метаболизма и увеличением летальности [28]. При кардиогенном, геморрагическом и травматическом шоках также наблюдается снижение StO2 и кислородного резерва периферических тканей, что отражает наличие тяжелой гипоперфузии и коррелирует с тяжестью состояния больного [6,13,35]. Снижение StO2 у больных в критических состояниях и после реанимационных мероприятий является предиктором увеличения летальности [11,24,25] и развития полиорганной недостаточности [8]. Есть сообщения об использовании ТО на догоспитальном этапе у пациентов после тяжелой сочетанной травмы [38]. Таким образом, ТО является важным методом контроля периферического кровотока и оксигенации и достоверным предиктором неблагоприятного исхода критического состояния.
Широко известно, что во время анестезии, особенно у кардиохирургических больных, происходят выраженные нарушения микроциркуляции и изменяется потребление кислорода периферическими тканями. Однако, публикации о результатах использования ТО в анестезиологической практике противоречивы и немногочисленны. Например, есть данные, что у пациентов во время анестезии StO2 выше, чем у здоровых добровольцев [29]. Другие авторы описывают снижение StO2 во время операции, искусственного кровообращения (ИК) и в раннем послеоперационном периоде [31]. При этом у пациентов с сердечно-сосудистой патологией более низкие показатели StO2 во время анестезии являются предиктором более высокой послеоперационной летальности [31]. Также описано снижение кислородного резерва периферических тканей во время анестезии [32]. Несмотря на интерес клиницистов к StO2 как ориентиру для оценки различных состояний и проведения интенсивной терапии, во время оперативных вмешательств ТО проводится достаточно редко. Это в полной мере касается и кардиохирургических операций.
На наш взгляд, мониторинг ТО во время анестезии может быть использован не только для оценки региональной оксигенации, но и для анализа кратковременных сосудистых реакций (от нескольких секунд до 10 мин.). Подобные реакции происходят чаще всего за счет изменения сосудистого тонуса, сопровождаются динамикой артериального давления и отражают переходные физиологические процессы в работе сердечно-сосудистой системы. Их можно скорректировать объемной нагрузкой и/или дробным введением следовых доз вазопрессоров, снижением дозы или скорости введения препаратов для анестезии. Для полного представления о происходящих сосудистых реакциях и состоянии региональной оксигенации в целом, информации только о периферических тканях недостаточно. В тоже время, одновременный мониторинг тканевой и церебральной оксигенации во время анестезии в литературе не описан.
В связи с этим в нашем исследовании мы поставили следующие задачи:
- Оценить возможность оценки тканевой оксигенации с помощью тканевой оксиметрии в условиях оперативного вмешательства
- Провести параллельный мониторинг тканевой и церебральной оксигенации во время анестезии у кардиохирургических больных
- Изучить тканевую и церебральную оксигенацию во время кратковременных сосудистых реакций
Методы
Нами обследованы 44 пациента, оперированные в ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН в 2011 г. Больным 1 гр. (больные ИБС, АКШ+ИК, нормотермия, n=23) операции реваскуляризации миокарда выполнялись в условиях нормотермического кровообращения (t центральная = 36,0°С). У пациентов 2 гр. (больные ХСН, Клапан + АКШ+ИК, гипотермия, n=21) коррекция клапанной патологии и реваскуляризация миокарда проводились в условиях умеренной гипотермии (t центральная = 32,0°С). У всех больных проводилась сбалансированная многокомпонентная анестезия по принятой в Центре методике: вводная анестезия на основе мидазолама 0,05-0,08 мг/кг, кетамина 0,5-0,7 мг/кг, пропофола 0,5-0,7 мг/кг, фентанила 2,5-3,5 мкг/кг и пипекурониума бромида 0,1 мг/кг. Поддержание анестезии осуществлялось севофлюраном 0,5-1,0 МАС, а во время ИК - пропофолом 3-4 мг/кг?ч. Фентанил вводился инфузионно в дозе 3-4 мкг/кг?ч, а также добавлялся дробно на травматичных этапах операции по 2,5-3,8 мкг/кг. Поддержание миоплегии осуществлялось дробным введением пипекурониума бромида.
Мониторинг безопасности пациента проводился с помощью системы AS5 (General Electric) Артериальное давление измеряли прямым методом в а. radialis.
Тканевая оксиметрия. Суть метода и его применение
Метод основан на том, что оксигенированный (HbO2) и дезоксигенированный гемоглобин (Hb) по-разному поглощают свет. Спектроскопический интервал, в котором можно различить и измерить Нb и HbO2, находится в диапазоне волн 660-940 нм. Для оценки насыщения тканей кислородом с помощью ТО используется лазерное излучение. Сигнал тканевого оксиметра распространяется согласно закону Бугера — Ламберта — Бера и отражает информацию о сосудах диаметром менее 1 мм (артериолы, венулы, и собственно капилляры) [2].
ТО измеряет локальную концентрацию гемоглобина (сатурированного HbO2 и десатурированного Нb) и отражает региональную оксигенацию [15, 20]. Региональная оксигенация – это отношение окисленного гемоглобина к общему гемоглобину на капиллярном уровне в области измерения, определяется по формуле:
StО2 = (НbO2/(НbO2+Нb)) х 100%
В исследованиях, проведенных с использованием позитронной эмиссионной томографии, показано, что церебральная оксигенация (SctO2) отражает пропорциональное смешение артериальной (~30 %) и венозной крови (на ~70 %) [16]. Под тканевой оксигенацией (StО2) чаще всего понимают оксигенацию мышечной ткани (тенар, предплечье, икроножная мышца), в которой соотношение артериальной и венозной крови также составляет 25/75% [2].
Для оценки насыщения тканей кислородом с помощью БИКС, лазерное излучение проецируется с помощью одноразового датчика, устанавливаемого на поверхность тела. Два датчика анализатора располагаются на расстоянии 1,5 и 5 см от источника лазерного излучения. При проведении церебральной оксиметрии (ЦО) это позволяет исключить из анализа кожу и костные образования, а в случае проведения ТО – кожу и подкожную клетчатку (см. рис.1).
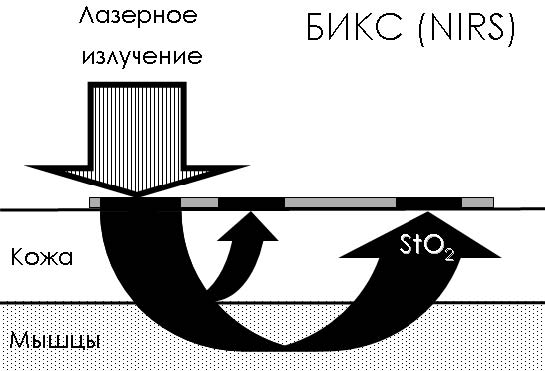
Рис. 1. Принцип работы тканевого оксиметра
В нашем исследовании использовался лазерный тканевой оксиметр FORE-SIGHT™ (CAS Medical System's ™, США). Датчики прибора располагались в проекции правого полушария и на правом предплечье. Показатели StO2 (%) и SсtO2 (%) анализировались в исходе (перед началом анестезии), после индукции (максимальный гипнотический эффект), перед ИК, в начале и конце ИК, в конце операции. Кроме того, проводился мониторинг показателей ТО на протяжении всей анестезии и анализ динамики оксиметрических показателей во время гемодинамических инцидентов.
В настоящее время отсутствуют общепринятые границы нормы церебральной и тканевой оксигенации, что обусловлено различиями в техническом устройстве оксиметров, использующих технологию БИКС (например, разная длина волны и т.д.) [5]. Ориентировочные показатели нормы церебральной оксигенации для FORE-SIGHT™ составляют 63-73% [26,27]. Разработчики прибора считают опасным уровень SctO2 менее 60% и вводят фактор времени (длительность эпизода более 15 мин.) в оценку результатов ЦО. Границы нормы тканевой оксигенации для оксиметра FORE-SIGHT™ по данным ряда авторов колеблются между 81 и 86% [13,17,31,35].
Отсутствие общепринятых норм для ТО обусловлено не только различиями в приборах, но и в том, что датчики оксиметра можно располагать в различных зонах. Большинство авторов используют в качестве места анализа мышцы тенара. Это объясняется тем, что толщина подкожно-жирового слоя здесь минимальна [34] и редко развивается отек тканей, который может влиять на точность измерения [2]. Однако, некоторые исследователи показали, что StO2 глубоких мышечных массивов (икроножная мышца) может нести больше информации для клиники [33]. В связи с этим в нашем исследовании мы располагали датчики на переднебоковой поверхности предплечья. Толщина подкожно-жирового слоя в этом месте не велика и значительно меньше проникающей способности прибора.
Отсутствие общепринятых норм приводит к тому, что многие авторы используют функциональные пробы для увеличения информативности и сопоставимости результатов исследований. В нашей работе мы использовали пробу с артериальной окклюзией (ПАО), которая является основной при исследовании StO2. [22].
Проба с артериальной окклюзией в анализе тканевой оксигенации
Для создания тестовой ишемии верхней конечности, после 5 минутного периода стабилизации давление в манжетке тонометра быстро (менее 5 сек) нагнеталось до уровня 240 мм рт. ст. [10,23]. Как и большинство исследователей, мы использовали ПАО, стандартизованную по времени (3 мин.) [29]. После 3 мин. пережатия артерии, давление быстро (менее 5 сек) сбрасывалось [3]. Оценивался StO2 min (%) – кислородный резерв, минимальный уровень оксигенации во время ПАО. Также анализировали StO2 max (%) – реактивную гиперемию после снятия окклюзии с конечности (см. рис. 2).
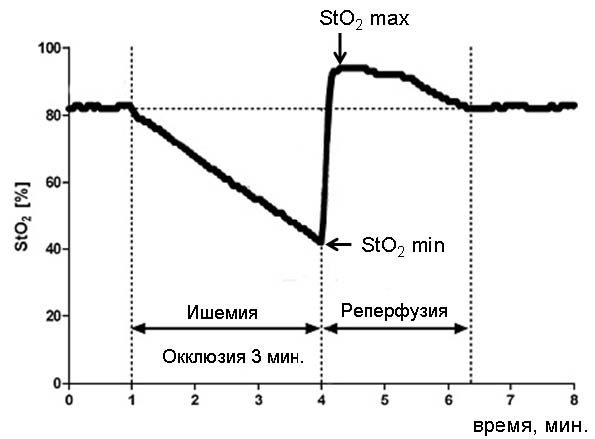
Рис. 2. Проба с артериальной окклюзией и тканевая оксиметрия [3, с изменениями]
Полученные результаты и их обсуждение
При анализе полученных результатов обнаружено, что в обеих группах динамика показателя церебральной оксигенации была сходной (см. рис. 3).
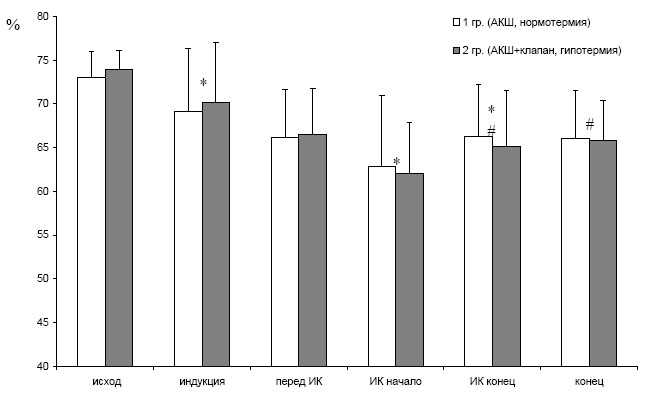
Рис. 3. Динамика церебральной оксигенации (SсtO2) во время анестезии
* – p<0,05 по сравнению предыдущим этапом, # – p<0,05 относительно исхода
SсtO2 снижалась после вводной анестезии и в начале ИК. В конце ИК SсtO2 была выше, чем в начале, что, по всей видимости, было отражением адаптации сосудов головного мозга к условиям ламинарного потока крови. Однако, в конце операции SсtO2 у всех больных была ниже, чем в начале анестезии.
Перед перфузией StO2 постепенно снижалась, а в начале ИК повышалась в обеих группах (см. рис. 4). В конце ИК тканевая оксигенация была выше у больных с клапанной патологией, оперированных в условиях умеренной гипотермии (77,4±5,89% против 70,3±6,8% p<0,02). Это можно объяснить тем, что потребление и/или кровоток в периферических тканях в условиях гипотермического ИК был снижен. В конце операции у всех больных показатели тканевой и церебральной оксигенации были ниже, чем в исходе.
Снижение церебральной и тканевой оксигенации во время операции, выявленное в нашей работе показало, что даже при адекватной анестезии мы не вполне контролируем региональную оксигенацию. Наши результаты совпадают с данными Sanders и соавт., которые показали, что у кардиохирургических больных StO2 снижается на протяжении операции с 78,9% до 69,9% [31].
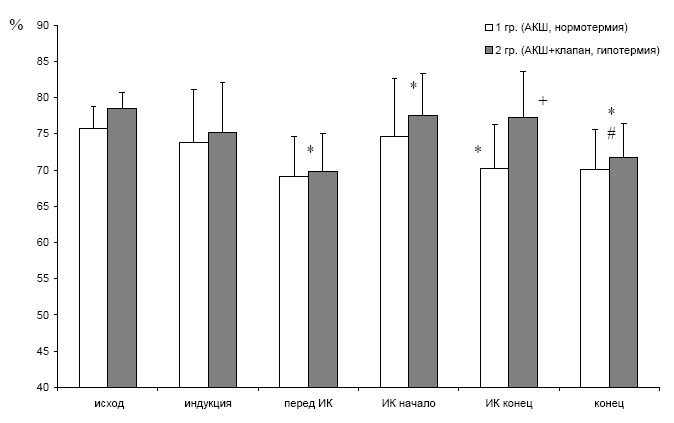
Рис. 4. Динамика тканевой оксигенации (StO2) во время анестезии
* – p<0,05 по сравнению предыдущим этапом, # – p<0,05 относительно исхода, + – p<0,05 относительно другой группы
Более того, насыщение тканей кислородом начинало возвращаться к норме только спустя 6 ч. после окончания операции, а у пациентов с более низкой StO2 была выше послеоперационная летальность [31]. Одной из причин нарушения тканевой перфузии может быть ИК. По данным Soller и соавт StO2 снижается во время ИК и остается ниже исходных величин в раннем послеоперационном периоде [32]. Снижение StO2 может быть очень чувствительным прогностическим признаком, что описано для сепсиса и шока различной этиологии [6,13,28,35]. Данный признак может выявляться у пациента раньше, чем происходит изменение других показателей. Например, возникает неэффективность кровообращения [38]. Для больных с сердечно-сосудистой патологией это имеет очень большое значение. При столь малочисленных группах больных некорректно делать глобальные выводы. Однако, опираясь на литературные данные не только анестезиологов, но и реаниматологов, можно предположить, что снижение StO2 во время анестезии является неблагоприятным прогностическим признаком.
Возможно, целесообразно рассматривать тканевую оксигенацию, как ориентир в проведении терапии во время анестезии. Например, интересные данные получены в экспериментальной работе, в посвященной терапии геморрагического шока [6]. Авторы выдвигают предположение, что StO2 может быть хорошим ориентиром для проведения реанимационных мероприятий при геморрагическом шоке. В тоже время влияние уровня волемии на состояние тканевой перфузии периферических тканей остается дискутабельным вопросом. Так, например, Jeger с соавт. не обнаружил влияние кровопотери (500 мл) у здоровых доноров на StO2 (тенар), несмотря на достоверное снижение артериального давления [10]. Однако другие исследователи не подтверждают это положение. В работе Torrela с соавт. показано, что потеря даже 2% ОЦК снижает насыщение периферического гемоглобина кислородом [36]. Soller с соавт. также показал, что индуцированная гиповолемия, которая создавалась с помощью разряжения в нижней половине тела (эквивалентно потере 500 мл ОЦК) приводила к снижению StO2 в мышцах руки [32]. В клинических работах по оценке коррекции гиповолемии показано, что волемическая нагрузка (500 мл коллоидного раствора) увеличивала скорость восстановления исходного уровня StO2 после ПАО [17].
На наш взгляд, одной из причин, затрудняющих интерпретацию показателей ТО, является смешанный характер капиллярного кровотока в мышцах, который на 75% состоит из венозной составляющей [2]. Кроме того, ТО не отражает непосредственно микроциркуляторный кровоток, и это делает интерпретацию абсолютных значений StO2 еще более сложным. StO2 отражает баланс между доставкой и потреблением кислорода в исследуемом регионе. Поэтому изменения этого показателя могут отражать как собственно изменения микроциркуляторного кровотока, так и/или изменения метаболизма в зоне обследования. Кроме того, одновременные изменения в скорости потока и метаболизме могут приводить к тому, что StO2 не изменится. Для получения более точной информации требуется проведение функциональных проб, например ПАО.
В нашей работе при анализе результатов ПАО было обнаружено, что уровень кислородного резерва (StO2 min) становится меньше от пробы к пробе, а уровень реактивной гиперемии (StO2 min) остается прежним. Это хорошо видно при последовательном рассмотрении результатов ПАО у больного (см. рис. 5).
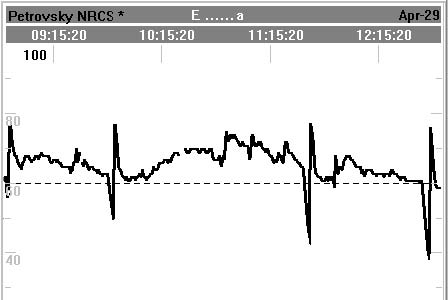
Рис. 5. Показатели StO2 во время ПАО у больной Е-вой, 59 л., 29-04-2011 г.
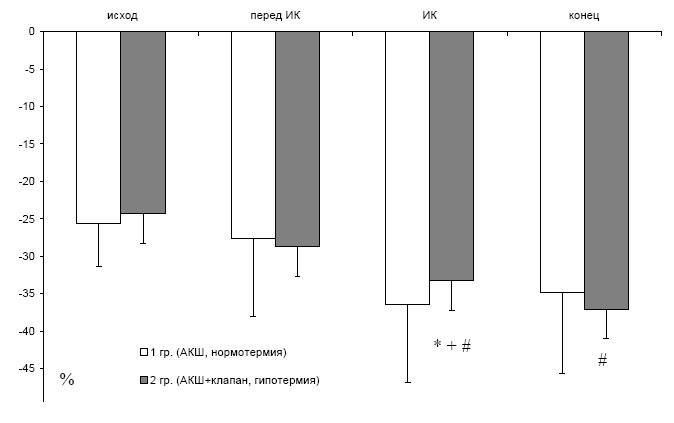
Риc. 6. StO2 min во время пробы с артериальной окклюзией
* – p<0,05 по сравнению предыдущим этапом; # – p<0,05 относительно исхода,
+ – p<0,05 относительно другой группы
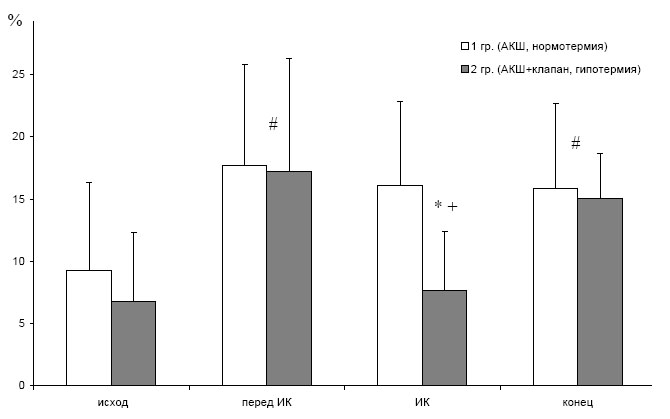
Рис. 7. StO2 max во время пробы с артериальной окклюзией
* – p<0,05 по сравнению предыдущим этапом, # – p<0,05 относительно исхода,
+ – p<0,05 относительно другой группы
Реактивная гиперемия во время анестезии становится выше только перед ИК (см. рис. 7). Однако, во время ИК у пациентов 1 гр. StO2 min был меньше, чем у больных 2 гр., а StO2 max был выше. Использование пробы с артериальной окклюзией (ПАО) значительно увеличивает информативность ТО [11], поскольку позволяет оценить состояние системы микроциркуляции и кислородный резерв периферических тканей [12, 18]. Постепенное снижение кислородного резерва в нашем исследовании подтверждает динамику показателей тканевой оксиметрии. В тоже время снижение StO2 min в 1 гр. требует особого внимания, т.к. отражает более высокий уровень потребления во время нормотермического ИК. Снижение кислородного резерва является неблагоприятным показателем и выявляется при различных патологических состояниях [35].
При оценке кратковременных сосудистых реакций мы отобрали эпизоды кратковременного снижения и повышения артериального давления. Было обнаружено, что такие эпизоды сопровождались значимыми изменениями как ЦО, так и ТО. При анализе всех случаев резкого снижения артериального давления, не обусловленного левожелудочковой недостаточностью, было выявлено снижение SсtO2 и повышение уровня StO2 (см. рис. 8).
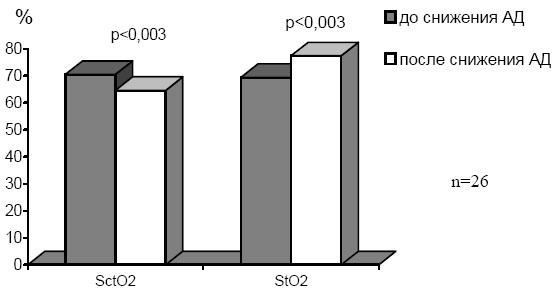
Рис. 8. Динамика SсtO2 и StO2 max во время снижения артериального давлен
Резкое снижение сердечного выброса приводило к одномоментному уменьшению обоих показателей региональной оксигенации. Такие эпизоды были выявлены всего у двух больных (по одному в каждой группе). В одном случае это было обусловлено острой левожелудочковой недостаточностью, которая потребовала начала ИК, а в другом – выраженной брадикардией.
При гипертензии наблюдалась обратная зависимость: SсtO2 повышалась, а ТО снижалась (см. рис. 9). Анализ динамики региональной оксигенации во время кратковременных сосудистых реакций показал, что тканевая оксигенация является чувствительным маркером происходящих сосудистых реакций, и ее изменения происходят несколько раньше изменений артериального давления.
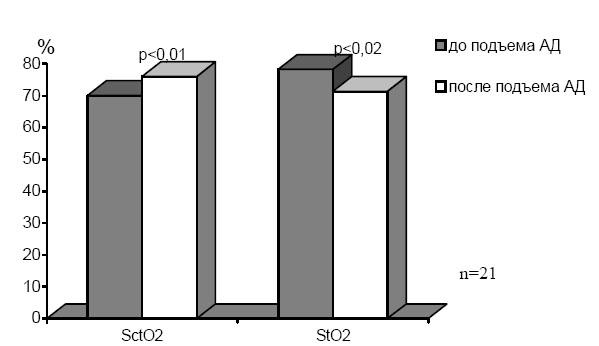
Рис. 9. Динамика SсtO2 и StO2 max во время повышения артериального давления
Например, выраженное увеличение ТО свидетельствует о резком уменьшении тонуса периферических сосудов, которое приводит к вторичному снижению церебрального перфузионного давления. В такой ситуации целесообразно использовать кратковременное введение вазопрессоров, не дожидаясь снижения артериального давления. Одновременное снижение ТО и ЦО говорит о значительном системном снижении кислородного транспорта, что чаще всего обусловлено резким снижением сердечного выброса.
Хотелось бы отметить, что в нашем исследовании только у двух пациентов были выявлены значительные по длительности эпизоды снижения показателей церебральной и тканевой оксиметрии ниже значения, которое производитель указал как пороговое (менее 60%, длительность эпизода более 15 мин). У одного из больных, несмотря на неосложненное течение раннего послеоперационного периода, экстубация была произведена позже в связи с наличием умеренной энцефалопатии. У второго пациента перевод на самостоятельное дыхание был произведен в обычные сроки и послеоперационный период протекал без особенностей.
Несмотря некоторую сложность интерпретации показателей региональной оксиметрии в практической работе анестезиологу было бы полезно иметь такой инструмент мониторинга, особенно для больных высокого риска. Мониторинг ТО не отнимает много времени, неинвазивен и нагляден. Дальнейшие исследования анестезиологов-реаниматологов позволят определить точные границы нормы тканевой оксигенации и оценить прогностическое значение ее снижения во время анестезии.
Выводы
- Тканевая оксиметрия может быть полезным инструментом оценки региональной оксигенации во время анестезии
- Во время анестезии у кардиохирургических больных, оперированных в условиях искусственного кровообращения, происходит снижение тканевой оксигенации
- Кислородный резерв периферических тканей во время операции постепенно снижается, и это более выражено во время нормотермического искусственного кровообращения
- Тканевая и церебральная оксиметрия позволяет оценить быстрые сосудистые реакции в различных регионах во время анестезии у кардиохирургических больных
- Тканевая перфузия при отсутствии сердечной недостаточности во время кратковременных сосудистых реакций изменяется обратно пропорционально артериальному давлению.
Список литературы
|
1 |
Петровский Б.В., Соловьев Г.М., Бунятян А.А. Гипотермическая перфузия в хирургии открытого сердца. Издательство «Айастан», Ереван, 1967 |
|
2 |
Backer D., Ospina-Tascon G., Salgado D. et. al. Monitoring the microcirculation in the critically ill patient: current methods and future approaches. Published 6 august 2010, Intensive Care Med., DOI 10.1007/s00134-010-2005-3 |
|
3 |
Bezemer R., Lima A., Myers D. et. al. Assessment of tissue oxygen saturation during a vascular occlusion test using near-infrared spectroscopy: the role of probe spacing and measurement site studied in healthy volunteers. Crit Care. 2009;13 Suppl 5:S4. Epub 2009 Nov 30. |
|
4 |
Boushel R, Piantadosi CA: Near-infrared spectroscopy for monitoring muscle oxygenation. Acta Physiol Scand 2000, 168:615-622. |
|
5 |
Boushel R., Piantadosi C. Near-infrared spectroscopy for monitoring muscle oxygenation. Acta Physiol Scand 2000, 168:615–622 |
|
6 |
Chaisson .N, Kirschner R., Deyo D. et. al. Near-Infrared Spectroscopy-Guided Closed-Loop Resuscitation of Hemorrhage J Trauma. 2003;54:S183–S192. |
|
7 |
Cohn S., Nathens A., Moore F. et. al. Tissue oxygen saturation predicts the development of organ dysfunction during traumatic shock resuscitation. J Trauma 2007, 62:44-54 |
|
8 |
Cohn S., Nathens A., Moore F. Tissue Oxygen Saturation Predicts the Development of Organ Dysfunction During Traumatic Shock Resuscitation J Trauma. 2007; 62:44 –55. |
|
9 |
Cohn S., Varela J., Giannotti G. Splanchnic perfusion evaluation during hemorrhage and resuscitation with gastric near-infrared spectroscopy. J Trauma 2001, 50:629-634. discussion 634-625 |
|
10 |
Creteur J, Carollo T, Soldati G, et al. The prognostic value of muscle StO2 in septic patients. Intensive Care Med 2007;33:1549–56. |
|
11 |
Creteur J. Muscle StO2 in critically ill patients. Curr Opin Crit Care. 2008 Jun;14(3):361-6. |
|
12 |
Creteur J., Carollo T., Soldati G. et al. The prognostic value of muscle StO2 in septic patients. Intensive Care Med 2007; 33:1549–56. |
|
13 |
Crookes B., Cohn S., Bloch S. et. al. Can near-infrared spectroscopy identify the severity of shock in trauma patients? J Trauma. 2005 Apr;58(4):806-13 |
|
14 |
Edmonds H. All Cardiac Surgical Patients Should Have Intraoperative Cerebral Oxygenation Monitoring. J of Cardiothoracic and Vasc Anesthesia, Vol 20, No 3 (June), 2006: pp 445-449 |
|
15 |
Ferrari M., Mottola L., Quaresima V. Principles, techniques, and limitations of near infrared spectroscopy. V. CanJ Appl Physiol. 2004 Aug; 29 (4):463-87. |
|
16 |
Fischer G., Lin H., Krol M. et. al. Noninvasive cerebral oxygenation may predict outcome in patients undergoing aortic arch surgery J Thorac Cardiovasc Surg. 2011 Mar; 141(3):815-21. Epub 2010 Jun 25. |
|
17 |
Futier E., Vallet B., Robin E. et. al. Use of near-infrared spectroscopy (NIRS) during a vascular occlusion test to assess the microcirculatory response during fluid responsiveness. Crit Care. 2010; 14(Suppl 1): P152. |
|
18 |
Gomez H., Torres A., Polanco P. et. al. Use of non-invasive NIRS during a vascular occlusion test to assess dynamic tissue O2 saturation response. Intensive Care Med, 2008 34:1600–1607 |
|
19 |
Harel F., Denault A., Ngo Q. et. al. Near-infrared spectroscopy to monitor peripheral blood flow perfusion. J Clin Monit Comput 2007 |
|
20 |
Jobsis F. Noninvasive infrared monitoring of cerebral and myocardial oxygen sufficiency and circulatory parameters. Science 198:1264–1267 |
|
21 |
Jones A., Puskarich M. Sepsis-Induced Tissue Hypoperfusion Crit Care Clin 25 (2009) 769–779 |
|
22 |
Kragelj R, Jarm T, Miklavcic D. Reproducibility of parameters of postocclusive reactive hyperemia measured by near infrared spectroscopy and transcutaneous oximetry. Ann Biomed Eng. 2000 Feb;28(2):168-73. |
|
23 |
Kragelj R., Jarm T., Erjavec T. et. al. Parameters of postocclusive reactive hyperemia measured by near infrared spectroscopy in patients with peripheral vascular disease and in healthy volunteers. Ann Biomed Eng. 2001 Apr;29(4):311-20. |
|
24 |
Lima A., van Bommel J., Jansen T. et. al. Low tissue oxygen saturation at the end of early goal-directed therapy is associated with worse outcome in critically ill patients. Crit Care. 2009;13 Suppl 5:S13. Epub 2009 Nov 30. http://ccforum.com/content/13/S5/S13 |
|
25 |
Lima A., van Bommel J., Sikorska K. et. al. The relation of near-infrared spectroscopy with changes in peripheral circulation in critically ill patients. Critical Care Medicine: July 2011 - Volume 39 - Issue 7 - pp 1649-1654 |
|
26 |
MacLeod D., Ikeda K., Keifer J. et. al. Validation of the CAS adult cerebral oximeter during hypoxia in healthy volunteers. Anesth Analg 2006; 102; S-1–S-330 |
|
27 |
MacLeod D., Ikeda K., Moretti E. et. al. Using the CAS Cerebral Oximeter To Estimate Cerebral Venous Oxygen Saturation. Anesthesiology 2005; 103: A16 |
|
28 |
Payen D., Luengo C., Heyer L. et. al. Is thenar tissue hemoglobin oxygen saturation in septic shock related to macrohemodynamic variables and outcome? Crit Care. 2009;13 Suppl 5:S6. Epub 2009 Nov 30. http://ccforum.com/content/13/S5/S6 |
|
29 |
Ranjan S., Thomson S., Tuccillo M. et. al. Anaesthesia Induced Changes in Tissue Saturation in Response to Vascular Occlusion Test Care Med. 2009; 35 (Suppl 1):S157. |
|
30 |
Rothoerl R., Faltermeier R., Burger R. et. al. Dynamic correlation between tissue PO2 and near infrared spectroscopy. Acta Neurochir Suppl 2002, 81:311-313. |
|
31 |
Sanders J., Toor I., Yurik T. et. al. Tissue Oxygen Saturation and Outcome after Cardiac Surgery Am J Crit Care March 2011 vol. 20 no. 2 138-145 doi: 10.4037/ajcc2011739 |
|
32 |
Soller B., Idwasi P., Balaguer J., et al. Noninvasive, near infrared spectroscopic-measured muscle pH and PO2 indicate tissue perfusion for cardiac surgical patients undergoing cardiopulmonary bypass. Crit Care Med 2003;31:2324–2331 |
|
33 |
Soller B., Ryan K., Rickards C. et. al. Oxygen saturation determined from deep muscle, not thenar tissue, is an early indicator of central hypovolemia in humans. Crit Care Med 2008, 36:176-182. |
|
34 |
Soller B., Yang Y., Soyemi O. et. al. Noninvasively determined muscle oxygen saturation is an early indicator of central hypovolemia in humans. J Appl Physiol 2008, 104:475-481. |
|
35 |
Strahovnik I., Podbregar M. Measurement of skeletal muscle tissue oxygenation in the critically ill. Signa Vitae 2008; 3(1): 43 - 50 |
|
36 |
Torella F., Cowley R., Thorniley M. et. al. Regional tissue oxygenation during hemorrhage: can near infrared spectroscopy be used to monitor blood loss? Shock 2002, 18:440-444. |
|
37 |
Varela J., Cohn S., Giannotti G. Near-infrared spectroscopy reflects changes in mesenteric and systemic perfusion during abdominal compartment syndrome. Surgery 2001, 129:363-370. |
|
38 |
von Bergh M. , Madler C. Tissue Oxygen Saturation in the Emergency and Critical Care Setting. Emergency Medicine & Critical Care 2008. http://www.touchbriefings.com/ebooks/A18oxs/emedcritvol4/resources/23.htm |
